
无菌药品包装系统密封性指导原则
本指导原则阐述无菌药品包装系统的泄漏方式、泄漏风险、密封性试验方法选择、方法验证和结果评价等相关要求,为无菌药品包装系统密封性研究和评价提供指导。
包装系统密封性(Package integrity),与容器密闭系统密封性(Container closure integrity,CCI)同义,是指包装系统能够防止内容物损失,阻止微生物及可能影响药品质量的气体或其他物质的进入,保证药品符合必要的安全与质量标准。
包装系统密封性试验( Package integrity test ),与容器密闭系统密性 试 验(Container–closure integrity test, CCIT)或包装系统的泄漏试验(Package leak test)同义,指检测存在破裂或缝隙的包装系统产生任何泄漏的试验(包括理化或微生物试验方法),些检测可以确定泄漏的尺寸和/或位置。包装密封质量检测(Package seal quality test)是用于表征和监控与包装的密封有关的参数质量和一致性的检测,包装的密封质量可能影响包装保持完整性的能力。
最大允许泄漏限度(Maximum allowable leakage limit,MALL)指特定产品包装所能允许的最大泄漏率(或泄漏尺寸),该泄漏率(或泄漏尺寸)不影响产品质量,也不会对产品安全构成风险。固有包装完整性(Inherent package integrity)指采用无缺陷包装组件组装完好的容器密闭系统的泄漏率(或泄漏尺寸),可以衡量容器密闭系统的密封完整性。可接受的固有包装完整性应符合特定产品包装最大允许泄漏限度。确定性泄漏试验方法(Deterministic leak test method)在确定性泄漏试验方法中,要检测的泄漏是基于一系列可预见的事件。确定性泄漏试验是基于容易控制和监测的理化技术,获得客观的定量数据。
概率性泄漏试验方法(Probabilistic leak test method)与确定性泄漏试验方法相反,具有随机的特点。概率试验取决于一系列连续和/或同时发生的事件,每个事件均与由概率分布表述的随机结果相关,因此结果具有不确定性,需要大的样本量和严格的试验条件控制,以获得有意义的结果。
阴性对照(Negative control)是无已知泄漏的包装,是泄漏试验方法建立和验证中采用正常工艺组装组件的最佳包装。阴性对照在产品包装系统密封性试验中应可重现。模具控制样品(Master)是模拟实际包装的形状和设计而制作的包装原型、模型或样板。可由实心塑料或金属制成,或者只是一个特定的密封容器单元。用于模拟无泄漏的包装,通常用于系统适用性试验以验证仪器性能。
阳性对照(Positive control)指具有已知故意缺陷的包装,用于泄漏试验方法建立和验证研究。阳性对照应在包装系统构造、组装和组件加工的材料方面与阴性对照一致。
泄漏(Leakage)是物质(固体、液体或气体)通过包装壁上的破损处或通过包装组件之间的间隙进入或逃逸。
气体泄漏率(Gaseous leakage rate)是在特定温度和绝对压力或浓度差条件下通过泄漏路径的气体流速(以质量或体积为单位)的量度。泄漏率的大小是压力乘以体积再除以时间。如国际标准单位(SI)是帕斯卡立方米每秒(Pa·m3·s 39 -1),其他常用测量单位包括标准立方厘米每秒(std·cm3·s-1 或 sccs)和毫巴升每秒(mbar·L·s−1 40 )。
一、泄漏方式及质量风险
包装系统的密封性可实现对药品的保护作用,药品包装系统都应关注泄漏对药品质量的影响,不同的泄漏表现造成的质量风险也可能有所不同(见表 1),对于药品有无菌要求的包装系统更需要关注包装系统密封性对药品质量的影响。渗透一般指流体(如气体)进入、通过和流出无孔包装壁的过程,只有小部分分子能够通过屏障,其与泄漏不同,主要与材料本身的阻隔性能有关,故不在本指导原则的范围内。
表 1.泄漏产生的产品质量风险

二、包装密封质量检测
包装密封质量与封口性能是否符合质量要求有关,如袋的热合强度。通过检测密封质量确保密封属性、包装材料、包装组件、组装过程始终保持在确定的范围内。包装密封质量检测可表征包装封口的质量,监控工艺参数的一致性,进一步保证包装系统的密封性。
密封质量检测不能替代包装系统密封性试验,满足密封质量要求的包装可能仍然存在缺陷导致泄漏,比如密封强度满足要求的软袋包装系统可能因为袋体上的穿孔而发生泄漏。密封质量检测结果可以提供包装系统密封特性的有关信息,控制密封质量有助于保证包装系统密封性。密封质量检测和包装系统密封性试验结合起来可进一步确保包装系统的密封性。
根据不同的密封方式,常用的密封质量检测方法有以下几种:1)扭矩检测,即测量将螺纹帽盖到螺纹口容器上施加的力或拧开螺帽所需的力来考察密封性能;2)爆破强度试验;3)密封强度试验,即测量剥离热封部位两个粘合面所需的力;4)残余密封力(RSF)检测,即弹性体密封件施加到注射剂瓶口上的压缩力的间接测量;5)超声波检查法,通过超声信号传递到包装或物品的密封区域后,其信号强度的变化来检查其密封质量等,方法可见本指导原则附 11。
三、产品生命周期中包装系统的密封性研究
对包装系统密封性的评估和监测应从产品风险管理角度出发,贯穿产品的生命周期(参见图 1)。包装系统密封性的保证不是仅仅通过最终产品抽样检查或在线检查控制,还与包装系统/组件的设计、选择、生产,产品生产过程控制,贮藏运输管理等有关。不同的包装系统,在包装系统/组件的开发和加工及组装验证阶段,需确定包装系统的固有包装完整性,基于质量源于设计(QbD)的理念,应关注组件选择的匹配性以及工艺参数的设定和优化;在产品的生产阶段,当产品、包装设计、包装材料或生产/加工条件发生变更时,需考虑密封性的重新评价并在变更实施前完成风险评估;在药品稳定性考察初期和末期进行无菌检查,其他时间点可采用包装系统密封性检测替代,监测产品贮存过程中的质量变化。在产品生命周期中的各个阶段不断积累密封性评估和控制的知识、历史数据和经验,制定有效的密封性控制策略,有利于持续可靠地确保密封性符合预期要求。
四、密封性试验方法
包装系统的密封性试验方法可按照不同的分类方式进行分类:根据试验技术不同可分为理化方法和微生物方法。根据试验方法产生的结果是定量结果(可进行客观分析)还是基于对试验样品的特定质量、属性或特征的主观观察可分为定量方法和定性方法。
根据试验方法对包装系统破坏与否可分为破坏性和非破坏性方法:破坏性试验方法会损坏试验样品,产品不可回收使用,如微生物挑战法等;非破坏性方法(无损检测)不破坏产品,如质量提取法、真空衰减法等。根据试验方法的取样方式可分为离线和在线方法:离线方法是对非生产线上的产品进行取样考察,可使用非破坏性或破坏性方法。在线方法是对整批产品在连续填充和密封产品的包装制造过程中进行,应使用非破坏性方法。两者比较而言,离线方法的检测时间一般较在线方法的检测时间长,比在线试验方法更灵敏。在线方法可以即时反馈检测结果,需要时,可实时在线校正相关参数,更好地保证所有包装系统的密封性。
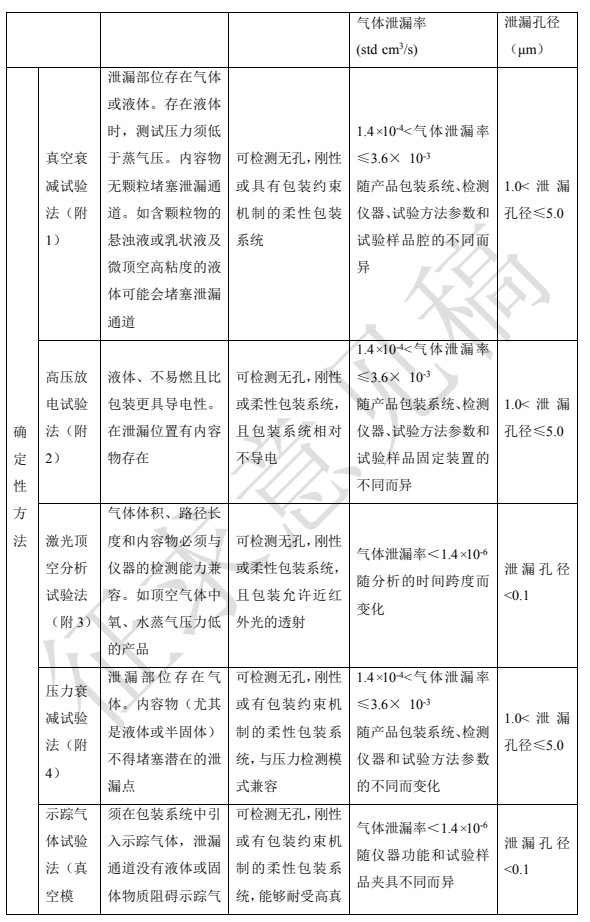
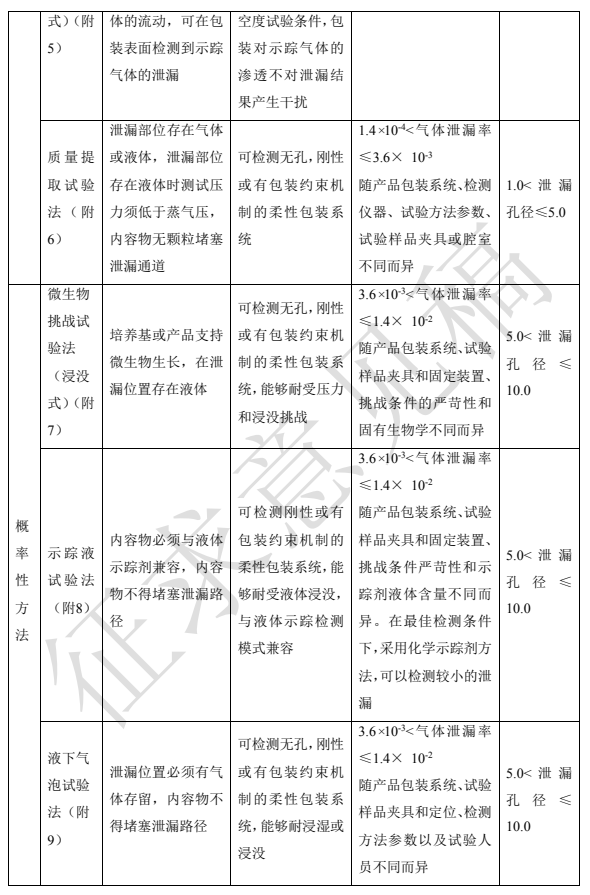
根据试验样品的结果是否为随机事件可分为确定性试验方法和概率性试验方法。常用方法见表 2。方法具体原理、设备、操作等见本指导原则附 1 到附 10。
五、密封性试验方法的选择
1.方法的选择因素
(1)包装系统内容物的特性
根据包装系统内容物的特性,对密封性试验方法进行选择。如真空衰减法要求产品不能堵塞泄漏通道;高压放电法要求内容物为液体、不易燃且比包装更具导电性;示踪液试验法要求内容物必须与液体示踪剂兼容,内容物不得堵塞泄漏路径;采用液下气泡法时,泄漏位置必须有气体存留,无颗粒物堵塞泄漏路径;采用质量提取法时固体药品包装中需要有一定量的顶空气体,产品无颗粒物堵塞泄漏路径;采用激光顶空分析试验法时,药品包装中存在顶空气体。此外不同的方法其灵敏度各异,还需结合不同药品质量控制要求来选择适宜的方法。
(2) 包装系统中组件材料的影响
对刚性材料,如玻璃包装系统,可以承受不同压力或真空挑战试验,适用的方法有真空衰减试验法、质量提取试验法、压力衰减试验法、示踪气体试验法、示踪液试验法等。而对于塑料袋这类包装系统,由于其材质在压差下可能发生变形,所以在使用压差原理的方法时,需要考虑采用特殊工具进行限位,使柔性包装具有约束机制,防止包装承受不同压力时发生蠕变或破裂导致密封被破坏。透明或半透明包装可透射激光, 也可开展目视检查,故可采用激光顶空分析试验法或示踪液试验法进行检测。
采用质量提取或真空衰减试验时,在真空试验条件下,需考虑有些塑料包装系统或含弹性体组件的包装材料,可能会释放挥发物,从而产生误判。对于一些阻隔性能较差的包装材料,采用示踪气体试验法检测时,也可能由于材料的气体渗透对结果产生干扰。
(3)包装系统中组件的固定性
不同包装系统组件的配合,有些是固定的(如塑料输液袋包装的接口和组合盖);有些在外力作用下可发生移动(如预灌封注射器的柱塞等)。所以选择的密封性试验方法如果需在不同压力条件进行试验(如示踪液体试验法、压力衰减试验法、真空衰减试验法、质量提取试验法),就需要对移动组件进行固定防止位移,保证试验结果的准确性。
(4)包装系统中组件的密封类型
包装组件的密封类型按照密封机理分为物理配合和理化结合两种。根据不同的密封类型可能产生的泄漏风险不同,可结合不同方法的特点进行选择。物理配合密封是通过表面材料不同的两种组件通过挤压等方式紧密配合实现密封,如活塞插入注射器针筒内的紧密配合、弹性密封件塞入注射剂瓶瓶口等。物理密封不是两者结合在一起,即使密闭良好的组件之间也可能存在微小的缝隙从而产生液体泄漏、微生物侵入或气漏,但是通过适当的设计和组装,物理配合密封也可以防止这些泄漏。理化结合密封是表面相似或不同的两个材料通过熔融等方式实现密封,如玻璃或塑料安瓿是单一材质熔封成型,塑料软袋是膜材通过热焊或超声焊接工艺完成熔封。这种方式可以有效防止液体泄漏和微生物侵入,但仍可能出现气体泄漏。
2.密封性试验方法的选择
选择密封性试验方法时,首先考虑包装内容物的特性,此外包装的设计结构、包装系统的材料、包装系统的密封类型以及最大允许泄漏限度等均会对方法的选择产生不同的影响,表 2 可为常用的密封性试验方法选择提供参考。本表中泄漏检测限作为方法选择时参考,实际泄漏检测限会随产品包装系统、检测仪器、检测方法参数设定和样品制备等不同而变化。
表2 密封性试验方法选择


六、密封性试验方法验证
密封性试验方法验证是为了证明针对不同包装形式和包装内容物,选用的试验方法满足相应的检测要求,尤其需关注方法灵敏度的考察,明确方法的检出能力。在方法验证之前进行仪器/设备确认,包括仪器/设备的功能评估以及使用适当的校准工具或标准品来模拟泄漏检测条件,确定仪器/设备的检测能力。
考虑到包装系统的设计、组件材料以及内容物等对试验结果的影响,在方法建立和验证中应设计和运用阳性对照以及阴性对照样品。阳性对照样品、阴性对照样品与试验样品具有相同的包装系统。阳性对照样品通过适宜的阳性对照样品制备方式制备(参照本指导原则附12),一般应制备至少 3 个不同尺寸孔径的阳性对照样品进行试验。适用时,方法建立和验证中也可采用模具控制样品。方法验证应结合方法的不同特点和预期用途开展,以下为方法验证一般考察内容,可结合不同方法特点开展(见本指导原则所附各方法)。
1.专属性 指存在可能引起误判的干扰因素时,该方法能准确区分包装是否泄漏的能力。
2.准确度 是正确区分泄漏超过声称检测限的包装与泄漏低于此限的包装(即不泄漏)的能力。
3.精密度 指该方法产生可靠,可重复数据的能力。在相同条件下,由同一个分析人员测定相同样品所得结果的精密度称为重复性。同一个实验室考察随机变动因素下(如不同日期、不同人员、采用不同仪器)测得结果之间的精密度称为中间精密度。在不同实验室由不同分
析人员获得样品测定结果之间的精密度称为重现性。
4.检测限 指对于给定包装系统,该泄漏试验方法能够可靠检出的最小泄漏率(或泄漏尺寸),又称检出限。
5.定量限 指一个泄漏试验方法在规定的试验条件下,在可接受的准确度和精密度范围内能确定的最小泄漏率或泄漏尺寸,且测定结果符合准确度和精密度要求。
6.线性 指试验结果与泄漏大小或泄漏率成比例关系的能力。不同的方法其线性要求不同。
7.范围 指特定泄漏试验方法在适当的准确度和精密度水平下,可检出的最小和最大漏孔(或泄漏率)的区间。不同的泄漏试验方法适用范围不同。
8.耐用性 指在方法参数有刻意的小变化时,该方法能够准确识别泄漏与非泄漏包装的能力,提示方法正常使用期间的适用性。
七、密封性试验方法系统适用性
系统适用性是指在当前试验环境下,设施、设备以及方法是否能够满足预期检测需求。确保泄漏试验方法所有可能产生变化或影响试验结果的因素(如仪器、分析人员、试验样品制备步骤和试验环境)被充分控制,并维持方法稳健和耐用的一种方式。通过系统适应性试验,确认泄漏试验方法和所有可能影响试验结果的关键因素均被正确控制,并在方法实施前预先设定。系统适用性对于所有泄漏试验方法都很重要。
八、密封性试验样品
开展包装系统密封性试验时,可根据产品生命周期不同阶段的要求,结合拟用方法的特点、药品及包装特性以及批生产规模等,结合既往药品生产及质量控制的经验,如验证阶段工艺控制的统计学结果以及产品正常生产时质量趋势的分析情况等,基于风险控制科学制定密封性试验的供试品取样量及抽样方案。
九、密封性试验结果评估
对大多数包装类型而言,即使是配合很好的密闭系统,也会存在一定的气体泄漏,所以评估包装系统密封性的实际意义是考察最大允许泄漏限度是否可以保证产品的质量。应基于科学和风险确定包装系统的最大允许泄漏限度,最大允许泄漏限度与药品质量要求密切相关,同时需考虑在产品生命周期内的工艺、贮藏、配送和使用情况对包装系统密封性的潜在影响。对特定的产品包装系统,需考虑密封性缺陷大小/类型,以及与微生物侵入和/或液体通过风险的关系,建立有意义的最大允许泄漏限度。如果包装系统的泄漏不大于最大允许泄漏限度,
可认为包装具有良好的密封性。
考察包装系统最大允许泄漏限度时可根据产品质量的要求,按以下类别考虑。
1.须保持产品无菌和内容物组分含量不变,但无需保证顶空气体组分不变。该类产品最大允许泄漏限度的控制主要与内容物组分流失、外部固体、液体的进入以及微生物的污染有关。有研究表明,一定条件下,刚性包装的液体挑战试验中,包装存在标称直径约0.1μm的漏孔时,液体泄漏的风险较小,存在标称直径约0.3μm的泄漏孔径时开始出现微生物侵入风
险。基于此研究结果,采用氦质谱(真空模式)检查刚性包装获得的最大允许泄漏限度小于
6×10 187 -6mbar·L/s时,相当于存在标称直径0.1-0.3μm的漏孔,微生物侵入的概率小于0.10,可保证较低的微生物侵入和液体泄漏风险,可不进行额外的微生物侵入挑战研究。
2.须保持产品无菌、内容物和顶空气体组分不变。这类产品的包装不仅要防止产品组分流失,产品受到外部液体、固体物质或微生物污染,还必须能保持顶空气体的组成不变(如真空包装或充氮产品等)。产品的最大允许泄漏限度可根据最大允许包装顶空气体含量或压力随时间变化趋势来确定,必要时还需考虑渗透带来的影响。
3.多次使用的无菌产品。这类产品为多剂量包装,可能采用过滤器、活塞或其他组件,防止产品使用及两次使用之间微生物侵入和产品泄漏风险的发生。如注射剂产品的弹性密封件,注射针穿刺使用后,其具有的自密封性可以在穿刺后对药品提供再保护,以确保其使用期间产品损失和微生物侵入的风险降到最低;多剂量眼用制剂包装封口设计有过滤器、塞子等,允许产品使用的同时限制微生物进入和产品泄漏。此类产品的最大允许泄漏限度可根据微生物侵入风险、预防产品损失和产品质量要求等确定。上述 1、2 类产品包装的密封性要求也适用于多次使用的无菌产品。
不同的密封性试验方法在适用范围、检测限等方面不尽相同,没有一种泄漏试验方法可适用于所有包装系统,对不同的药品及包装系统,需结合产品的特点进行方法选择。对包装系统密封性的评价包括但不限于密封性试验结果,还应结合包装系统组件构成和工艺特点,生产时工艺控制的统计结果和质量趋势分析来综合评价。
来源:药典委
原文下载:![]() 无菌药品包装系统密封性指导原则标准草案征求意见稿(24年12月).pdf
无菌药品包装系统密封性指导原则标准草案征求意见稿(24年12月).pdf

 冀公网安备 13010802000997号
冀公网安备 13010802000997号 微信扫一扫
微信扫一扫