
0123 口服溶液剂 口服混悬剂 口服乳剂公示稿(第 2 次)
0123 口服溶液剂 口服混悬剂 口服乳剂
口服溶液剂系指原料药物溶解于适宜溶剂中制成的供口服的澄清液体制剂。
口服混悬剂系指难溶性固体原料药物分散在液体介质中制成的供口服的混悬液体制剂。也包括浓混悬剂或干混悬剂。非难溶性药物也可以根据临床需求制备成干混悬剂。
口服乳剂系指用两种互不相溶的液体将药物制成的供口服等胃肠道给药的水包油型液体制剂。
用适宜的量具以小体积或以滴计量的口服溶液剂、口服混悬剂或口服乳剂称为滴剂。
口服溶液剂、口服混悬剂和口服乳剂在生产与贮藏期间应符合下列规定。
一、 口服溶液剂的溶剂、口服混悬剂的分散介质一般用水。
二、 根据需要可加入适宜的附加剂,如抑菌剂、抗氧剂、分散剂、助悬剂、增稠剂、助溶剂、润湿剂、缓冲剂、乳化剂、稳定剂、矫味剂以及色素等,其品种与用量应符合国家标准的有关规定。其附加剂品种与用量应符合国家标准的有关规定。
三、 除另有规定外,在制剂确定处方时,应评估和考察加入抑菌剂的必要性、抑菌剂类型和加入量,;如需加入抑菌剂,若加入抑菌剂,该处方的抑菌效力应符合抑菌效力检查法(通则 1121) 的规定。
四、 口服溶液剂通常釆用溶剂法或稀释法制备;口服乳剂通常采用乳化法制备;口服混悬剂通常釆用分散法制备。
五、 制剂应稳定、无刺激性,不得有发霉、酸败、变色、异物、产生气体或其他变质现象。
六、 口服乳剂的外观应呈均匀的乳白色,以半径为 10cm 的离心机每分钟 4000 转的转速(约 1800×g)离心 15 分钟,不应有分层现象。乳剂可能会出现相分离的现象,但经振摇应易再分散。
七、 口服混悬剂应分散均匀,放置后若有沉淀物,经振摇应易再分散。
八、 除另有规定外,应避光、密封贮存。
九、 口服滴剂包装内一般应附有滴管和吸球或其他量具。
十、口服混悬剂在标签上应注明“用前摇匀”;以滴计量的滴剂在标签上要标明每毫升或每克液体制剂相当的滴数。除另有规定外,口服溶液剂、口服混悬剂和口服乳剂应进行以下相应检查。
【装量】除另有规定外,单剂量包装的口服溶液剂、口服混悬剂和口服乳剂的装量,照下述方法检查,应符合规定。
检查法 取供试品 10 袋(支),将内容物分别倒入经标化的量入式量筒内,检视,每支装量与标示装量相比较,均不得少于其标示量。
凡规定检查含量均匀度者,一般不再进行装量检查。多剂量包装的口服溶液剂、口服混悬剂、口服乳剂和干混悬剂照最低装量检查法(通则 0942)检查,应符合规定。
【装量差异】除另有规定外,单剂量包装的干混悬剂照下述方法检查,应符合规定。
检查法 取供试品 20 袋(支),分别精密称定内容物,计算平均装量,每袋(支)装量与平均装量相比较,装量差异限度应在平均装量的±10%以内,超出装量差异限度的不得多于 2 袋(支),并不得有 1 袋(支)超出限度 1倍。凡规定检查含量均匀度者,一般不再进行装量差异检查。
【干燥失重】除另有规定外,干混悬剂照干燥失重测定法(通则 0831)检查,减失重量不得过 2.0%o
【沉降体积比】口服混悬剂照下述方法检查,沉降体积比应不低于 0. 90。
检查法除另有规定外,取供试品摇匀后,用具塞量筒量取供试品 50ml,密塞,用力振摇 1 分钟,记下混悬物的开始高度 H。静置 3 小时,记下混悬物的最终高度 H0,按下式计算:
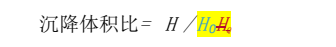
干混悬剂按各品种项下规定的比例加水振摇,应均匀分散,并照上法检查沉降体积比,应符合规定。
【微生物限度】除另有规定外,照非无菌产品微生物限度检查:微生物计数法(通则 1105)和控制菌检查法(通则 1106)及非无菌药品微生物限度标准(通则 1107)检查,应符合规定。
0123 口服溶液剂 口服混悬剂 口服乳剂第二次公示修订说明
根据首次公示反馈意见和建议,进行以下修订:
1. 针对制剂在确定处方与开发阶段,增加抑菌效力研究要求的文字描述
进行了进一步完善和修订。
2. 对【沉降体积比】检查法中部分描述进行完善和修订。
来源:药典委
原文下载:![]() 0123 口服溶液剂 口服混悬剂 口服乳剂(第二次公示).pdf
0123 口服溶液剂 口服混悬剂 口服乳剂(第二次公示).pdf

 冀公网安备 13010802000997号
冀公网安备 13010802000997号 微信扫一扫
微信扫一扫