
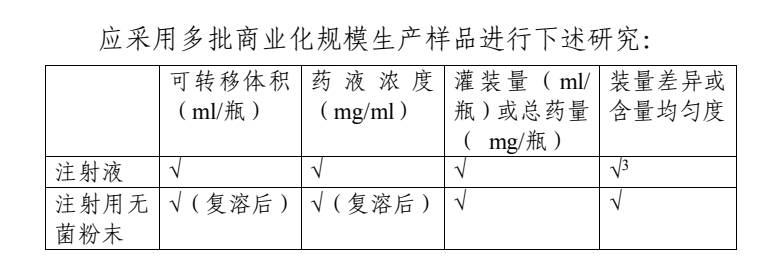
注射剂的过量灌装是指每个容器中药品的灌装量较标示量适当增加的体积或重量,以确保实际给药剂量满足说明书中规定的用量。为完善化学仿制药注射剂过量灌装的药学研究和申报资料要求,结合国内外仿制药研发与生产现状,
制定本指导原则。本指导原则仅适用于采用安瓿瓶和西林瓶包装的化学仿制药注射剂上市申请和上市后相关变更研究(如,可能影响灌装体积的变更等),不适用于其他包装形式的注射剂(如,预灌封包装系统、静脉输液袋等)。本指导原则仅代表药品监管部门对于该问题的当前认知,旨在为新申报的化学仿制药注射剂上市申请和相关研究提供指导。随着相关法规的不断完善以及药物研究技术要求的提高,本指导原则中的关内容将不断完善与更新。
鉴于包材粘附等原因,为了保证实际给药剂量满足说明书中规定的用量,应适当增加装量。增加的装量应能确保每支(瓶)产品的可转移剂量均不低于标示量。同时,增加的装量不应造成明显的药物过量而引起安全性方面的风险,以及给药后药瓶中残留药品过多可能用于第二剂而造成的药品污染、错用等风险。根据中国药典通则,注射剂的灌装标示装量不大于50ml时,可参考中国药典推荐的易流动液和粘稠液过量灌装量,适当增加装量。为确保仿制药用法用量与参比制剂的一致性,化学仿制药注射剂的过量灌装宜与参比制剂保持一致,如不一致需提供合理性论证,应确保每支(瓶)产品的实际给药剂量均不低于标示量。
申请人应充分调研参比制剂信息,包括相关专利、文献、公开的审评报告、说明书等,并对多批参比制剂进行详细研究,综合分析参比制剂的过量灌装情况。
化学仿制药注射液的浓度应与参比制剂标示浓度保持一致。为保证每支(瓶)产品均能转移并使用标示的给药剂量,可参考中国药典适当增加灌装量1。
申请人可按下式计算灌装量范围:
灌装量下限=标示装量+过量体积(ml)
灌装量上限=标示装量×合理论证的系数+过量体积(ml)
申请人在确定灌装量上限时,应对系数进行合理论证,
可能的考虑因素包括但不限于灌装精度、产品特点等(下同)。
注射用无菌粉末在临用前需用适宜的溶剂配制后使用,应确保每瓶产品的实际给药剂量均不低于标示量。根据参比制剂说明书中用法,其过量灌装研究可分为以下两种情形。参比制剂说明书中明确复溶后浓度的情形:根据参比制剂说明书的用法进行复溶后,仿制药最低灌装量的复溶后药物浓度应与说明书中规定的复溶后药物浓度一致。应对仿制药复溶后药液总体积进行研究2,按下式计算总药量范围:
总药量下限=复溶后标示浓度(mg/ml)×复溶后总体积
总药量上限=复溶后标示浓度(mg/ml)×合理论证的系数×复溶后总体积
参比制剂说明书中未明确复溶后浓度的情形:
根据参比制剂说明书的用法进行复溶后,仿制药的可转移剂量应满足说明书标示的给药剂量。
应对灌装前药液浓度、灌装过程中灌装量范围进行合理控制,提供控制范围制订依据。
四、申报资料要求
申请人应在申报资料中提供过量灌装的相关研究资料。过量灌装量应在 CTD 通用技术文档“3.2.P.1 剂型及产品组成”部分进行描述;相关研究验证资料(如,可转移体积测试、黏度研究、灌装量范围等)和过程控制应在 CTD 通用技术文档“3.2.P.2 产品开发、3.2.P.3 生产”部分进行描述。
五、说明书和标签
如适用,建议参照参比制剂说明书,在【用法用量】项下标注复溶后药液浓度。为避免临床用药困惑,过量灌装量通常不需要在标签和说明书中特别说明。
六、名词解释
可转移体积:系指根据中国药典规定的【装量】检查方法或其他适宜且经过验证的方法,液体药物或固体药物复溶后可以从原容器中转移的体积。
可转移剂量:系指根据可转移体积和药物浓度(注射液)/复溶后药物浓度(注射用无菌粉末)计算得到的活性成分的量。
灌装量:系指西林瓶或安瓿瓶中注射液的液体总量(如,ml),包括标示装量和增加的体积。
总药量:系指西林瓶中的注射用无菌粉末中活性成分的总量(如,mg),包括标示装量和增加的药量。
标示量: 系指说明书和标签中标示的活性成分的量。
七、参考文献
1.中国药典 2020 年版四部通则 0102
2.国家药品监督管理局. 化学药品注射剂仿制药质量和疗效一致性评价技术要求. 2020
3. FDA. Guidance for Industry:Allowable Excess Volumeand Labeled Vial Fill Size in Injectable Drug and Biological
Products.2015
4.FDA. Allowable Excess Volume/Content in InjectableDrug and Biological Products(MAPP 5019.1 Rev 1).2022
5.ICH Steering Committee, Harmonised Tripartite
来源:CDE

 冀公网安备 13010802000997号
冀公网安备 13010802000997号 微信扫一扫
微信扫一扫