
ICH 协调指导原则
模型引导的药物研发一般原则
M15ICH共识指导原则
1 引言
1.1 目的
本指导原则为模型引导的药物研发(MIDD)证据(以下简称“MIDD 证据”1)的规划、模型评价和资料整理提供一般建议,并建立 MIDD 证据统一的评估框架(包括相关术语)。
1.2 背景
就本指导原则而言,MIDD 的定义为策略性采用计算建模和模拟(M&S)2方法,整合非临床和临床数据、先验信息和知识(例如药物3和疾病特征)以生成证据。生成的证据用于为药物研发和药物研发者、监管机构和其他利益相关方的决策提供相关信息。M&S 方法可单独使用或组合使用,包括但不限于以下方法:
群体药代动力学
基于生理的药代动力学和生物药剂学剂量-暴露-效应关系
基于模型的荟萃分析定量系统药理学和毒理学
基于主体的模型疾病进展模型
MIDD 证据被定义为应用 MIDD 证据评估框架(包括模型评价)而确定,适用于为回答所关心问题提供信息的模型结果。虽然术语“模型”或“建模”并非始终与“M&S”同义,但在本指导原则中“模型”或“建模”通常用来表示“M&S”,以提高可读性并反映常用术语习惯。就本指导原则而言,术语“药物”为试验药品、药品、生物制品的同义词,包括寻求上市许可的在研“药物”。
ICH M15 指导原则
人工智能/机器学习
1.3 适用范围
有关 MIDD 的 ICH M15 指导原则适用于当前和新兴的 M&S 方法及应用,侧重于评估
MIDD 证据,并为相关的监管互动、报告和资料提交提供建议。本指导原则旨在促进对 MIDD 和相关证据生成的多学科理解,应与相关特定主题的 ICH 指导原则(例如 E4、E5、E6、E7、S7B、E11[R1]/E11A、E14、M12、E17、E9/E9[R1])结合使用。
本指导原则不包括模型开发技术方面的细节。因此,模型开发应遵循本指导原则中概述的建议,并结合与所用 M&S 方法相关的当前公认标准和/或科学实践。
1.4 内容概要
药物开发是一个连续和迭代的过程,MIDD 可以在其中发挥重要策略性作用。当 MIDD证据可能有助于回答目标问题时,提前规划可以将即将产生的数据纳入到总体药物研发计划。新的目标问题可能会出现,并且随着数据和知识的积累,相关计划也会发生变化。其中一些迭代可能需要与监管机构合作,以就 MIDD 计划达成一致。
因此,本指导原则确定了为决策提供信息的 MIDD 证据的评估框架(第 2 节),及其在“计划和监管互动”至“实施、报告和提交”过程中的使用方法。该过程分为五个不同的连续活动。指导原则概述(表 1)提供了这些活动与相关指导原则章节和小节之间的联系。某些活动可能并非总是必需的,可以考虑合并或同时进行。同样,活动顺序也不一定单向,因为新出现的数据和见解可能会要求重复进行某些活动。
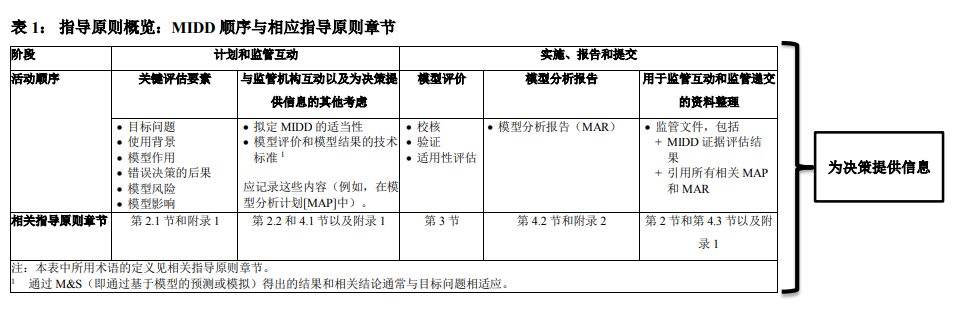
MIDD 证据的评估框架
本节描述了为决策提供信息的 MIDD 证据评估的关键概念。为了支持监管互动和资料提交,附录 1 中提供了 MIDD 证据评估表(以下简称“评估表”)。药物研发者应将该评估表用作与监管机构沟通的工具,以增加透明度,并在计划阶段提供其对 MIDD 的理解。鼓励药物研发者在寻求早期多学科监管意见之前,先使用评估表达成多学科共识。尽早与监管机构达成一致有助于后续 MIDD 证据的接受。以下子章节在方框中提供了评估表中相关要素的定义,然后对使用评估表提供说明和指导。
2.1 关键评估要素
关键评估要素及其定义如下所示。风险和影响评估的结果分别表示为“模型风险”和“模型影响”。模型风险是确定模型评价要求的关键。模型风险和模型影响均用于MIDD 计划、沟通和证据评估。
目标问题:期望 MIDD 回答的问题。
使用背景:对模型及其在回答目标问题时的具体作用和范围的描述。背景应简
要描述模型、用于构建模型的数据、模型结果的具体作用以及有助于回答目标问题的其他数据或证据。
模型作用:考虑到其他相关信息的作用,模型结果在决策中的预期权重。错误决策的后果:若根据所有可用信息而做出错误决策所产生的后果(例如,关于患者安全性和/或有效性)。
模型风险:模型结果对可能的错误决策及其后续潜在不良后果的影响程度。模型风险应理解为在解决特定目标问题背景下的风险,不应将其视为 MIDD 或M&S 的内在风险。模型风险评估应用于计划和协调模型评价的要求,并应用于确定 MIDD 证据评估结果。模型评价应与模型风险相称,并随着风险增大而加强(见第 3 节)。
模型影响:相较于当前监管期望或标准,模型结果在回答目标问题时的贡献程度。模型影响评估应作为沟通和早期协调的一部分,并将用于确定 MIDD 证据评估结果。
模型风险和模型影响评估是一个多步骤过程,具体如下:指明目标问题:第一步,明确说明将通过 MIDD 解答的目标问题。这样可以提供一个有助于指导多学科讨论的框架。应注意的是,目标问题可能比模型的预期用途更广泛。确定使用背景:应简洁、清晰和明确地描述模型、用于构建模型的数据、模型结果的具体作用以及有助于回答目标问题的其他数据或证据。
进行模型风险评估:通过(i)模型结果在某一决策的总体证据中的贡献程度,即模型影响,以及(ii)错误决策的潜在后果,综合确定模型风险。应根据目标问题和使用背景,对模型影响和错误决策后果二者均进行描述并分级为低、中或高,并证明分级的合理性。应对产生的模型风险进行描述并分级为低、中或高,并证明分级的合理性。
进行模型影响评估:应对监管影响程度进行描述并分级为低、中或高,并证明分级标准的合理性。低、中或高分级可能会因具体情况而异,这使得证明分级合理性至关重要。
2.2 与监管机构互动以及为决策提供信息的其他考虑因素除了第 2.1 节中描述的关键要素外,还应包括以下内容,以便为与 MIDD 计划和/或MIDD 证据提交相关的决策提供信息,并应提供给监管机构进行相关监管互动。
MIDD 计划阶段:
· 拟定 MIDD 的适当性:提出理由,说明拟定 MIDD 为何适合回答目标问题并涵
盖相关关键假设和所需数据。 技术标准:用于确定模型可接受性的模型评价和模型结果关键标准的总结和依据(例如,使用生物等效性接受限值等接受标准)。MIDD 证据提交阶段
4,6
· 模型评价:简要讨论模型技术评价7的主要结果和结论。 MIDD 证据评估结果:对用于回答目标问题的 MIDD 证据的多学科评估的简要总结。
为了促进监管互动,药物研发者应提供拟定 MIDD 的适当性依据,并强调随着模型风险增大,应加强模型评价(见第 3 节)。应记录技术标准的详细信息(例如,在模型分析计划[MAP]或会议背景材料中记录;见第 4.3 节),并鼓励药物研发者与监管机构共享信息以达成一致;当模型风险高时这点尤为重要(见第 4.1 节)。如果出现新信息或数据,且需变更技术标准,则鼓励药物研发者与监管机构进一步达成一致(见第 2.1 节)。在 MIDD 证据提交阶段,除了模型技术评价的关键结果总结之外,药物研发者还应提供模型风险和影响评估结果。药物研发者应提供对 MIDD 证据评估结果的初步结论。
一般而言,MIDD 计划和 MIDD 证据提交是按顺序进行的。在实践中,与 MIDD 计划和证据提交相关的主题也可能在同一监管互动中解决。这些项目也应在 MIDD 证据提交阶段提供。
本文中的“提交”是指在药物的整个生命周期中向监管机构提供药物相关信息。使用第节中描述的模型评价原则,特别关注技术标准。本文中的“评估”并不指任何监管审查活动或流程。
在 MIDD 计划和证据提交阶段寻求监管意见时,鼓励药物研发者直接请求监管机构的MIDD 专家以及其他专家根据使用背景进行审查和提供意见。鼓励药物研发者总结和分享从其他监管机构收到的关于同一主题的互动结论和意见。如第 2 节引言中所述,鼓励尽早寻求多学科监管意见,并促进后续对拟定应用的接受,尤其是在 M&S 方法较新或模型风险和/或模型影响预计较高的情况下。
3 模型评价
本节概述了模型评价要素(即校核、验证和适用性评估)和相关一般建议。这些要素应用于确定模型对于目标问题回答的可接受性,形成 MIDD 证据评估的基础,为相关决策提供信息(见第 2 节)。模型评价应遵循与特定 M&S 方法相关的当前公认标准和或科学实践,并与模型风险相称(见第 2 节)。
本节中对模型评价的描述和一般建议有意从较高层面呈现,以利于涵盖不同 M&S 方法。采取这些建议可确保采取适当行动,为决策提供信息。模型评价的要素定义如下。
· 校核活动旨在确保用于处理数据和进行分析的用户生成的代码(即由编程语言或软件用户编写的指令)无误,反映模型假设的方程及其在编程语言或软件中的表示正确,且计算准确。
· 验证活动旨在评估模型稳健性和性能的充分性。验证活动包括评估以下各项的相关性和适当性:数据、模型的概念形式(即整体结构和复杂性)、模型假设、模型开发方法以及模型性能和外部验证的图形和数值方法。一个重大基本原则是模型与数据、先验信息和知识之间的比较。
模型适用性(也称为“符合目的”)描述了数据和模型在回答目标问题方面的相关性和充分性。在对验证和校核结果进行评估后,应针对每个目标问题进行适用性评估。
以下是对模型评价要素的一般建议。
校核应记录关键用户生成代码、公式和计算的校核结果,且可供监管机构审查。应记录计算机软件(用于 M&S 相关数据管理和分析)的质量保证结果,包括适当的软件测试程序,以及安装和版本追踪。有关软件验证的更多信息,请参考 ICH E6指导原则。
验证和适用性
应证明数据在回答目标问题方面的相关性和适当性。应提供排除数据的理由,并评估出现偏倚的可能性。一般而言,应在 MAP 和模型分析报告(MAR)中指定、证明并记录数据选择、相关转换和缺失值填补情况。
· 模型结构和参数应与药物特性、药理学、生理学和疾病病理生理学(如相关)的现有知识一致。
· 鼓励采用独立数据进行外部验证,以评估模型性能的充分性,并在满足相关技术标准时增加对其拟定应用的信心。
应充分描述模拟方法和场景,以便能够评估其合理性以及与模型适用性的相关性,并考虑参数和假设的不确定性。
建议预先确定涵盖模型评价活动和技术标准的 MAP(见第 4.1 节)。对拟定分析进行变更应有适当理由,并应记录在 MAR 中。
4 MIDD 报告和提交
以下章节中提供了关于 MAP(第 4.1 节)、MAR(第 4.2 节)以及监管互动和提交相关文件(包括评估表)(第 4.3 节)的建议。
4.1 模型分析计划(MAP)
建议在 MAP 中预先确定并记录每次模型分析。MAP 的相关要素通常包括引言、目的(包括预期模型结果)、数据和方法(例如,技术标准的详细信息),且应与相应 MAR 章节(见第
4.2 节和附录 2)保持一致。在监管互动期间提供 MAP 可以促进讨论(见第 2.2 节)。当模型风险为高时,这一点尤其重要。
4.2 模型分析报告(MAR)
提交给监管机构的模型分析结果都应记录在 MAR 中。有关 MAR 章节的描述,请参见附录 2。应使用相应的评估表,以总结单个 MAR 或多个 MAR 中支持相关问题答案的关键模型结果(见第 4.3 节和附录 1)。如果制定了 MAP,则应提供相关的 MAR。
4.3 监管互动和提交的资料整理
以下是对 MIDD 证据记录的一般建议。多次 MAR 和/或其他来源的 MIDD 证据支持一个相关问题时,应在评估表中简洁地提供综合摘要。应在会议背景材料或通用技术文件章节中提供更多详细信息,并交叉引用来源文件。
评估表和所有相关文件(如 MAP、MAR、临床研究报告)应根据相关问题引用或纳入相应监管文件(如会议背景材料、通用技术文件章节)的最合适章节。所有支持所提交 MIDD 证据的独立文件、M&S 分析中所用数据、模型编码脚本(例如,群体药代动力学的基础和最终模型)以及其他相关电子文件、定义文件和所用脚本均应提交,以供监管审查和评估。鼓励在会议背景材料和其他相关监管文件中纳入关于 MIDD 的相关监管反馈摘要。
来源:CDE
原文下载:![]() 【中文】M15模型引导的药物研发一般原则(草案).pdf
【中文】M15模型引导的药物研发一般原则(草案).pdf

 冀公网安备 13010802000997号
冀公网安备 13010802000997号 微信扫一扫
微信扫一扫