
药物制剂稳定性研究,首先应查阅原料药物稳定性有关资料,特别了解温度、湿度、光线对原料药物稳定性的影响,并在处方筛选与工艺设计过程中,根据主药与辅料性质,参考原料药物的试验方法,进行影响因素试验、加速试验与长期试验。
(一)影响因素试验
药物制剂进行此项试验的目的是考察制剂处方的合理性与生产工艺及包装条件。供试品用1批进行,将供试品如片剂、胶囊剂、注射剂(注射用无菌粉耒如为西林瓶装,不能打开瓶盖,以保持严封的完整性),除去外包装,并根据试验目的和产品特性考虑是否除去内包装,置适宜的开口容器中,进行高温试验、高湿试验与强光照射试验,试验条件、方法、取样时间与原料药相同,重点考察项目见附表。对于需冷冻保存的中间产物或药物制剂,应验证其在多次反复冻融条件下产品质量的变化情况
(二)加速试验
此项试验是在加速条件下进行,其目的是通过加速药物制剂的化学或物理变化,探讨药物制剂的稳定性,为处方设计、工艺改进.质量研究、包装改进、运输、贮存提供必要的资料。供试品在温度40℃+2℃、相对湿度75%+5%的条件下放置6个月。所用设备应能控制温度+2,相对湿度+5%,并能对真实温度与湿度进行监测。在至少包括初始和未次等的3个时间点(如0、3、6月)取样,按稳定性考察项目检测。如在25℃+2℃、相对湿度60%±5%,条件下进行长期试验,当加速试验6个月中任何时间点的质量发生了显著变化,则应进行中间条件试验。中间条件为30℃+2℃、相对湿度65%+5%,建议的考察时间为12个月,应包括所有的稳定性重点考察项目,检测至少包括初始和末次等的4个时间点(如0、6、9、12月)。溶液剂、混县剂、乳剂、注射液等含有水性介质的制剂可不要求相对湿度,试验所用设备与原料药物相同,
对温度特别敏感的药物制剂,预计只能在冰箱(5℃+3'℃)内保存使用,此类药物制剂的加速试验,可在温度25℃+2℃、相对湿度60%+5%的条件下进行,时间为6个月。
对拟冷冻贮藏的制剂,应对一批样品在5℃+3℃或25°+2℃条件下放置适当的时间进行试验,以了解短期偏离标签贮藏条件(如运输或搬运时)对制剂的影响。
乳剂、混县剂、软膏剂、乳喜剂、糊剂、凝胶剂、眼营剂、栓剂、气剂、泡腾片及泡腾颗粒宜直接采用温度30℃±2℃、相对湿度65%+5%的条件进行试验,其他要求与上述相同。
对于包装在半透性容器中的药物制剂,例如低密度聚乙烯制备的输液袋、塑料安甑、眼用制剂容器等,则应在温度40℃±2℃、相双湿度25%+5%的条件(可用CH:COOK·1.5H,O饱和溶液)进行试验。
(三)长期试验
长期试验是在接近药品的实际贮存条件下进行,其目的是为制订药品的有效期提供依据。供试品在温度25℃+2℃℃、相对湿度60%+5%的条件下放置12个月,或在温度30℃+2℃、相对湿度65%+5%的条件下放置12个月。至于上述两种条件选择哪一种由研究者确定。每3个月取样一次,分别于0个月、3个月、6个月、9个月、12个月取样,按稳定性重点考察项目进行检测。12个月以后,仍需继续考察的,分别于18个月、24个月、36个月取样进行检测。将结果与0个月比较以确定药品的有效期。由于实测数据的分散性,一股应按95%可信限进行统计分析,得出合理的有效期。如3批统计分析结果差别较小,则取其平均值为有效期限。若差别较大,则取其最短的为有效期。数据表明很稳定的药品,不作统计分析。
对温度特别敏感的药品,长期试验可在温度5℃+3℃的条件下放置12个月,按上述时间要求进行检测,12个月以后,仍需按规定继续考察,制订在低温贮存条件下的有效期。
对拟冷冻贮藏的制剂,长期试验可在温度-20℃+5℃的条件下至少放置12个月,货架期应根据长期试验放置条件下实际时间的数据而定。
对于包装在半透性容器中的药物制剂,则应在温度25℃+2℃、相对湿度40%+5%,或30℃+2℃、相对湿度35%+5%的条件进行试验,至于上述两种条件选择哪一种由研究者确定。
对于所有制剂,应充分考虑运输路线、交通工县、距离、时间、条件(温度、度、振动情况等)、产品包装(外包装、内包装等)、产品放置和温度监控情况(监控器的数量、位置等)等对产品质量的影响。
此外,有些药物制剂还应考察临用时配制和使用过程中的稳定性。例如,应对配制或稀释后使用、在特殊环境(如高原低压、海洋高盐零等环境)使用的制剂开展相应的稳定性研究,同时还应对药物的配伍稳定性进行研究,为说明书/标签上的配制、贮藏条件和配制或稀释后的使用期限提供依据.
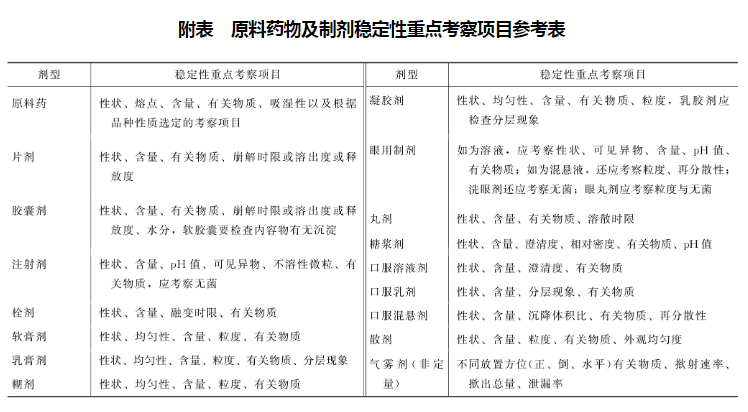
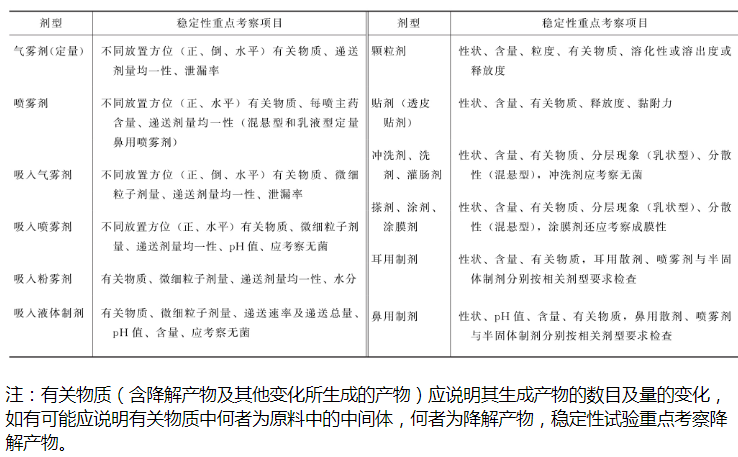
稳定性重点考察项目
原料药物及主要剂型的重点考察项目见附表,表中未列入的考察项目及剂型,可根据剂型及品种的特点制订。对于缓控释制剂、肠溶制剂等应考察释放度等,微粒制剂应考察粒径、或包封率、或泄漏率等。

 冀公网安备 13010802000997号
冀公网安备 13010802000997号 微信扫一扫
微信扫一扫